來源:網絡資源 2022-11-24 20:13:50
一、酸堿指示劑
1.定義:能跟酸或堿的溶液起作用而顯示不同顏色的物質叫做酸堿指示劑。
2. 常見的酸堿指示劑有紫色石蕊溶液和無色酚酞溶液。
3. 紫色石蕊溶液遇酸溶液(含H+的溶液)變紅,遇堿溶液(含OH-的溶液)變藍,在中性溶液中呈紫色。
4.無色酚酞溶液遇酸溶液不變色,在中性溶液中不變色,遇堿溶液變紅。
5.注意: 并非所有的鹽溶液都是中性的。
水溶液呈堿性的鹽:純堿、小蘇打等。
水溶液呈酸性的鹽:硫酸銅、硫酸氫鈉等。
二、干燥劑
1. 我們學過的干燥劑有氫氧化鈉、濃硫酸、氧化鈣、氯化鈣等。
氫氧化鈉易潮解;濃硫酸具有吸水性;而氧化鈣可以與水反應:CaO+H2O=Ca(OH)2
2.氫氧化鈉
氫氧化鈉等堿性干燥劑不能干燥氯化氫、二氧化碳、二氧化硫等酸性氣體。
3.濃硫酸
濃硫酸等酸性干燥劑不能干燥氨氣等堿性氣體。
三、復分解反應
定義:兩種化合物互相交換成分,生成另外兩種化合物的反應叫復分解反應。
2. 特點:交換成分,價態不變。
3. 反應發生的條件:生成難電離的物質(水、氣體或沉淀)。
四、酸的定義和分類
酸:物質溶于水時,形成的陽離子全部是H+的化合物。
由于酸、堿、鹽溶于水時會電離出陰、陽離子,所以酸、堿、鹽的水溶液具有導電性。

酸的電離:公式[公式],公式[公式]
五、常見的酸

注: 濃硫酸能將紙張、木材、布料、皮膚中的氫、氧元素按水的組成比脫去,這種作用通常叫做脫水作用。
鹽酸、硝酸、醋酸具有揮發性;碳酸不穩定,容易分解成二氧化碳和水。
硝酸、硝酸銀見光易分解,所以它們要放在棕色試劑瓶中。
濃硫酸的稀釋操作:
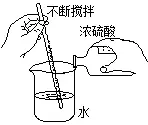
六、酸的化學性質
酸有相同的化學性質是因為酸在水中都能電離出公式[公式],有不同的化學性質是因為能電離出的酸根離子不同。
1.酸溶液能使酸堿指示劑變色:使紫色石蕊溶液變紅。
2.酸+活潑金屬 → 鹽+氫氣(置換反應)
a) 這里不包括濃硫酸和硝酸。
b) 示例:公式[公式]和公式[公式]
【現象】鐵表面有氣泡產生;溶液由無色逐漸變為淺綠色(公式[公式]的鹽溶液呈淺綠色)。
3.酸+金屬氧化物 → 鹽+水(復分解反應)
a) 金屬氧化物可以是活潑金屬的氧化物和不活潑金屬的氧化物。因為生成物有水,符合復分解反應的發生條件,所以反應一定發生。
b) 示例1:公式[公式]和公式[公式]
【現象】鐵銹逐漸溶解消失;溶液由無色逐漸變成黃色(公式[公式]的鹽溶液呈黃色)。
c) 示例2:公式[公式]和公式[公式]
【現象】黑色粉末逐漸溶解消失;溶液由無色逐漸變成藍色(公式[公式]的鹽溶液呈藍色)
4.酸+堿 → 鹽+水(復分解反應、中和反應)
5.酸+鹽 → 新酸+新鹽(復分解反應)
a) 反應發生的條件:①新酸是碳酸等弱酸(強酸制弱酸); ②如果新酸不是弱酸,新鹽必須是沉淀。
b)碳酸鹽都能與強酸反應(形成氣體):公式[公式](碳酸不穩定,分解成二氧化碳和水)
c)除硫酸鋇以外的鋇鹽都能與硫酸反應:公式[公式](注意:HCl是稀鹽酸,不寫↑)
d)硝酸銀能與鹽酸反應:公式[公式]
七、堿的定義和分類
堿:物質溶于水時,形成的陽離子全部是公式[公式]的化合物。

四大強堿都可以溶于水,但弱堿不能溶于水。氨水是氨氣溶于水形成的液體。
在初中化學范圍內,只有氫氧化銅是藍色沉淀,氫氧化鐵是紅褐色沉淀。
氨水的電離是公式[公式],所以氨水也是堿。
鉀、鈉、鈣的氧化物能與水反應生成相應的堿。如:公式[公式]
八、常見的堿
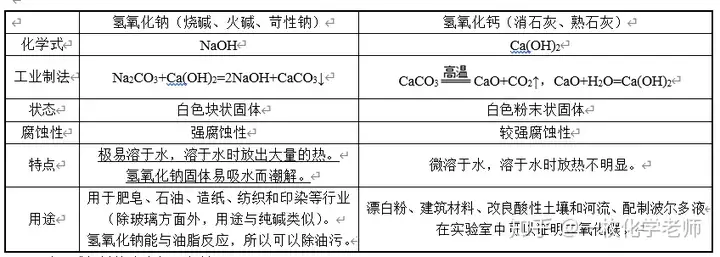
酸、堿包括其溶液都要密封。
澄清的石灰水就是氫氧化鈣的水溶液。
氫氧化鈉必須密封有兩個原因:① 吸水性;② 能與空氣中的二氧化碳反應:公式[公式]。
九、堿的化學性質
堿有相同的化學性質是因為不同的堿溶液中都含有相同的公式[公式]。
1.堿溶液(四大強堿的溶液、氨水)能使指示劑變色:使紫色石蕊溶液變藍,使無色酚酞溶液變紅。
由于弱堿不溶于水,所以弱堿不能使指示劑變色(氨水除外)。
2.堿+非金屬氧化物 → 鹽+水(復分解反應)
a) 反應發生的條件:① 堿是四大強堿; ② 非金屬氧化物是二氧化碳、二氧化硫、三氧化硫等(高中階段還會有其他非金屬氧化物)。
b) 根據條件我們可以寫出十二個化學方程式,但必須掌握的四個化學方程式是:
公式[公式](用氫氧化鈉溶液吸收二氧化碳)
公式[公式]
公式[公式]
公式[公式](檢驗二氧化碳;石灰墻“出汗”)
3.堿+酸 → 鹽+水(復分解反應、中和反應)
在堿的通性中,弱堿只有該性質。
4.堿+鹽 → 新堿+新鹽(復分解反應)
a) 反應發生的條件:① 反應物能溶于水(包括氫氧化鈣,不包括其他微溶于水的物質); ② 新堿是氨水; ③ 若新堿不是氨水,新堿和新鹽中至少有一個沉淀。
b)銨鹽一定能與四大強堿反應。
c) 新堿是沉淀:
藍色沉淀 –公式[公式]
紅褐色沉淀 –公式[公式]
白色沉淀 –公式[公式]
d) 新鹽是沉淀:
公式[公式]
公式[公式]
e) 藍白沉淀:公式[公式]
f) 紅白沉淀:公式[公式]
g)波爾多液(注:波爾多液不是溶液):公式[公式]
弱堿在加熱的條件下會分解成金屬氧化物和水。如
![]()
但需要注意的是,強堿沒有該性質,該性質不屬于堿的通性。
十、氫氧化鈉和氫氧化鈣變質
1. 氫氧化鈉變質
氫氧化鈉變質是因為與空氣中的二氧化碳反應生成碳酸鈉。
證明方法:
a)取樣,加過量的稀鹽酸,如果有氣泡產生,說明氫氧化鈉已經變質:
公式[公式]和公式[公式]
b)取樣,加氫氧化鈣溶液,如果有白色沉淀產生,說明氫氧化鈉已經變質:
公式[公式]
c)取樣,加氯化鈣(或硝酸鈣)溶液,如果有白色沉淀產生,說明NaOH已經變質:
公式[公式]或公式[公式]
2. 氫氧化鈣變質
氫氧化鈣變質是因為與空氣中的二氧化碳反應生成碳酸鈣。
證明方法:取樣,加入過量的稀鹽酸,如果有氣泡產生,說明氫氧化鈣已經變質:
公式[公式]
公式[公式]
3. 氫氧化鈉固體和氫氧化鈣固體變質時,固體質量都會增加。
十一、氫氧化鈉和氫氧化鈣部分變質
1. 氫氧化鈉部分變質的證明方法:
①取樣,(如果是固體,就需要加適量水,使固體完全溶解),加過量的氯化鈣(或硝酸鈣)溶液,如果有白色沉淀產生,說明碳酸鈉存在:
公式[公式]或公式[公式]
② 過濾,向濾液中滴加酚酞溶液,如果濾液變紅,說明氫氧化鈉存在,氫氧化鈉部分變質。
2. 氫氧化鈣固體部分變質的證明方法:
①取樣,加適量水使固體完全溶解,加入過量的稀鹽酸,如果有氣泡產生,說明碳酸鈣存在:
公式[公式]
②另取少量固體,加氯化銨(或硫酸銨)研磨,如果聞到刺激性氨味,說明氫氧化鈣存在,氫氧化鈣部分變質:公式[公式]或公式[公式]
十二、中和反應
定義:酸和堿作用生成鹽和水的反應。
酸和強堿反應,一般沒有明顯的實驗現象(沉淀、氣泡、不溶物溶解消失、溶液顏色變化),所以為了觀察反應是否發生,需要借助酸堿指示劑。
如公式[公式],反應的時候要進行以下操作:
①在燒杯中加入氫氧化鈉溶液;
②滴入幾滴酚酞溶液;
③用滴管慢慢地滴入稀鹽酸,并不斷用玻璃棒攪拌(如果容器是試管,就直接振蕩);
④溶液由紅色剛剛褪成無色時,說明氫氧化鈉和鹽酸恰好完全反應。
(注意是先加堿溶液,再加指示劑,然后才加酸)
做上述實驗時,如果在實驗過程中忘加酚酞,在實驗結束后再加酚酞溶液,發現酚酞不變色,會有兩種情況:酸堿恰好完全反應或者酸過量。這時加入碳酸鈣固體,如果有氣泡產生,說明酸過量;如果沒有氣泡產生,說明恰好完全反應。
雖然不能用酚酞溶液鑒別酸性溶液和中性溶液,但借助一種堿溶液,就能將酸性和中性溶液區分出來。
在所有的復分解反應中,中和反應優先發生,并且反應可以瞬時完成。
中和反應是放熱的反應。
中和反應的應用
熟石灰改良酸性土壤(在缺少熟石灰的情況下,用生石灰也可以)。
熟石灰改良酸性河流(處理硫酸廠的污水:公式[公式])。
鐵粉、蛋殼(主要成分是碳酸鈣)也可改良酸性河流,但它們不屬于中和反應。
碳酸水改良堿性土壤。
用含氫氧化鋁或氫氧化鎂的藥物中和過多的胃酸:
公式[公式]
小蘇打、墨魚骨粉(主要成分是碳酸鈣)也可以治療胃酸過多,但它們不屬于中和反應。
被蚊蟲叮咬時涂含氨水(或者是牙膏、肥皂水)的藥物。
中和反應同氧化反應、還原反應一樣,是特征反應,不屬于四大基本反應類型。
十三、酸堿度
溶液的酸堿度用pH表示。pH的范圍通常在0~14之間。
酸性溶液的pH < 7,中性溶液的pH = 7,堿性溶液的pH > 7。
公式[公式]的濃度越大,溶液的酸性越強,pH越小;公式[公式]的濃度越大,溶液的堿性越強,pH越大。
溶液中公式[公式]或公式[公式]的濃度改變,則pH會相應改變。
測定pH的最簡單方法是使用pH試紙。
pH試紙的使用步驟:在白瓷板或玻璃片上放一小片pH試紙,用玻璃棒將待測液體滴到pH試紙上,將pH試紙顯示的顏色與標準比色卡比較。
使用pH試紙時的注意事項:
①不能把pH試紙浸在待測液體中。
②pH試紙不能用水潤濕。
③pH試紙測出的pH值是整數。
十四、 鹽的概述
1. 鹽的定義:由金屬離子(或公式[公式])和酸根離子形成的化合物。
2. 幾種常見的鹽
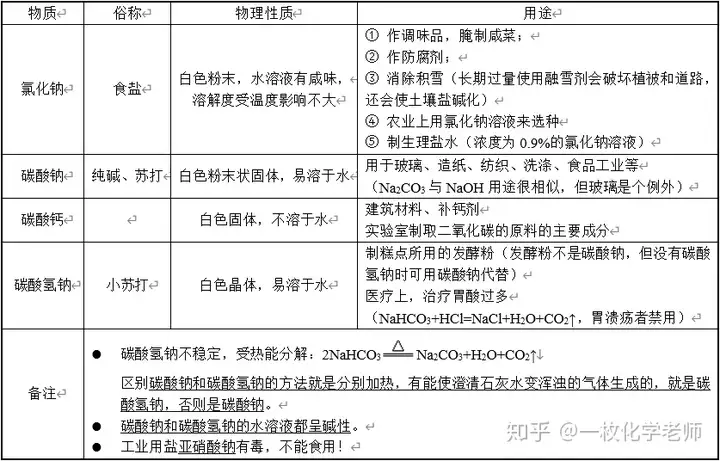
3. 消毒用鹽
游泳池一般用硫酸銅消毒。
醫療上一般用高錳酸鉀消毒。
過去習慣用氯氣給自來水消毒,現在用二氧化氯消毒。
4. 侯氏制堿法:又名聯合制堿法。主要產物是碳酸鈉,此外還有副產品是氯化銨。
5. 鈉離子可以維持細胞內外的水分分布,促進細胞內外物質交換;氯離子可以促生鹽酸、幫助消化,增進食欲。
6. 氯化鈉等溶于水后,會使水的凝固點降低,以達到溶雪的目的。氯化鈉作為融雪劑,對植物有害,會腐蝕橋梁等,所以現在逐漸被綠色融雪劑代替。
十五、 粗鹽提純
1. 粗鹽的初步提純只是去除不溶性雜質,得到的精鹽中還含有氯化鎂、氯化鈣等可溶性雜質。
2. 粗鹽中由于含有氯化鎂、氯化鈣等雜質,易吸收空氣中的水分而潮解。無水氯化鈣可用作干燥劑。
3.實驗步驟:溶解、過濾、蒸發、回收。
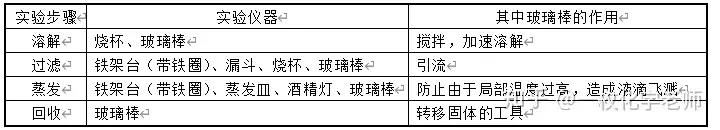
4. 蒸發時要經常用玻璃棒攪拌液體,防止由于局部溫度過高造成液滴飛濺。
5. 當水接近全部蒸發時熄滅酒精燈,停止加熱,利用余熱使剩余水分蒸發。
十六、鹽的化學性質
1.鹽(可溶)+ 金屬1 → 金屬2 + 新鹽(金屬1比金屬2活潑,金屬不是鉀、鈣、鈉)
2.鹽 + 酸 → 新鹽 + 新酸
3.鹽 + 堿 → 新鹽 + 新堿(反應物需都可溶,且滿足復分解反應的條件)
4.鹽 + 鹽 → 兩種新鹽(反應物需都可溶,且滿足復分解反應的條件)
注:部分不溶于水的鹽只具有性質2。
氯化銀、硫酸鋇既不溶于水,也不溶于酸(不溶于酸就是不與酸反應)。
十七、 酸、堿、鹽的溶解性(室溫)
1. 酸:大多數都可溶。
2. 堿:只有氨水、氫氧化鈉、氫氧化鉀、氫氧化鋇和氫氧化鈣可溶于水,其余均為沉淀。
3. 鹽:鉀鹽、鈉鹽、銨鹽、硝酸鹽都可溶。
4. 氯化物除氯化銀不溶于水外,其余多數均易溶于水(氯化不溶銀亞汞)。
5. 硫酸鹽除硫酸鋇不溶于水,硫酸銀、硫酸鈣微溶于水外,其余多數易溶于水(硫酸不溶鋇和鉛)。
6.碳酸鹽只有碳酸銨、碳酸鉀、碳酸鈉易溶于水。
歡迎使用手機、平板等移動設備訪問中考網,2025中考一路陪伴同行!>>點擊查看